Az ELKH Kísérleti Orvostudományi Kutatóintézet (KOKI) kutatói a pajzsmirigyhormon agyi transzportját vizsgálva alaptudományi és transzlációs szempontból egyaránt jelentős eredményeket értek el.
A KOKI csoportvezetői, Dr. Gereben Balázs és Dr. Fekete Csaba innovatív kutatási eszközt fejlesztettek ki a pajzsmirigyhormon (PMH) jelátvitelének sejttípus-specifikus vizsgálatára. A kutatók szabadalmaztatott egérmodelljének segítségével elért úttörő eredményeinek egyes vonatkozásai a pajzsmirigy-alulműködés (hipotireózis) kezelését is érintik. Ez azért fontos, mert a PMH gyakorlatilag minden szövetben a sejtműködés egyik fő szabályozója. A PMH különösen fontos szerepet játszik az agy működésének szabályozásában. A véráram keringő PMH-szintje viszonylag stabil. Ez éles ellentétben áll a PMH-szintek különböző szövetekben és sejttípusokban tapasztalható turbulens és gyors változásaival. Ezek a változások elengedhetetlenek ahhoz, hogy a szövetspecifikus PMH-jelátvitel megfeleljen a szövetek térben és időben is gyorsan változó PMH-igényének.
Az agy PMH-háztartása különösen összetett, mivel ez a szerv a PMH szabályozója és célpontja is egyben.
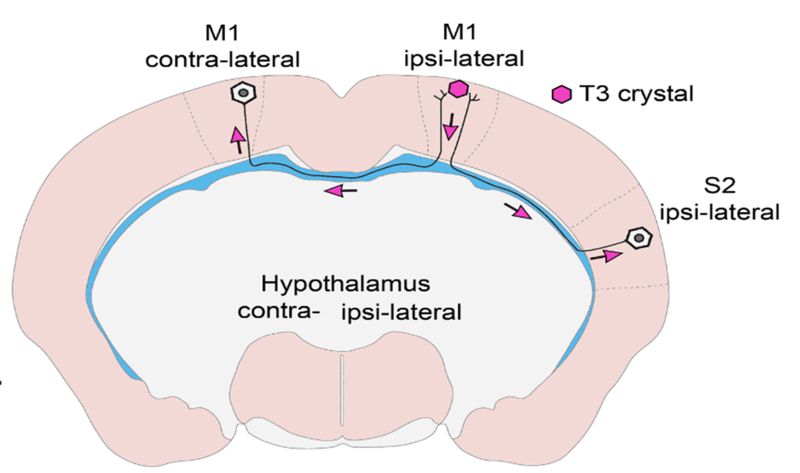
Mindeddig megoldatlan kérdés volt, hogy a T3, a PMH aktivált formája, hogyan jut el célpontjaihoz, hogy kiváltsa az agyban biológiai hatását. Leginkább az a nézet terjedt el, hogy ez parakrin módon történik, azaz a gliasejtek a T4 prohormonból T3-at előállítva látják el a szomszédjukban található neuronokat.
A kutatóknak összetett in vitro és in vivo kísérletek sorozatával sikerült bizonyítani, hogy a T3 retrográd módon, az idegsejtek axonnyúlványaiban utazva éri el az idegsejtek sejtmagját olyan hólyagocskákban (vezikulákban), amelyek megvédik a hormont az idegsejtekben nagy mennyiségben található T3-bontó enzimtől. Kimutatták, hogy a PMH-jelátvitel az agyban sokkal összetettebb, mint korábban gondolták. Az agykéregben keletkező T3 a hosszú, agyféltekéket összekötő (interhemiszférikus) axonokon keresztül eljuthat a másik oldali agykéregbe is. Így távol eső agyi régiók szabályozhatják egymás PMH-függő sejtaktivitását. Ezek a vizsgálatok arra a sokáig megoldatlan kérdésre is választ adtak, hogy a hipotalamusz-hipofízis-pajzsmirigy (HHP) tengelyt szabályozó idegsejtcsoport, azaz a hipotalamusz hipofiziotróp TRH-neuronjai hogyan kapják a T3-bemenetet a perifériás keringésből és a tanicitákból, a hipotalamusz PMH-aktiváló sejtjeiből.
Ez az egész testre hatással van. Mivel a TRH-neuronok PMH által kiváltott negatív visszacsatoláson alapuló szabályozása a HHP-tengely egyik kulcsfontosságú szabályozási mechanizmusa.
Az eredmények transzlációs vonatkozása is jelentős. Mivel megmagyarázza, hogy a hipotireózis ‒ pajzsmirigy-alulműködés/-hiány ‒ miatt alkalmazandó hormonpótló terápia során egyelőre még ritkán alkalmazott T4+T3 kombinációs terápia T3 komponense miért képes túlélni az agy T3-lebontó aktivitását. Ez előnyös lehet olyan PMH-pótlásban részesülő betegek számára, akik nem reagálnak jól a T4-monoterápiára.
A T3 agyban történő terjedésének tanulmányozására egyedülálló lehetőséget biztosított a magyar, európai uniós és USA-szabadalommal védett, Gereben Balázs és Fekete Csaba kutatócsoportjainak közös munkájával kifejlesztett pajzsmirigyhormon-hatás mérésére szolgáló (Thyroid Hormone Action Indicator, THAI) transzgenikus egérmodell.






No Comment