Magyar kutatók – Pál Gábor (ELTE TTK), valamint Dobó József és Gál Péter (MTA TTK) – a világon elsőként azonosították egy rejtélyes, korábban ismeretlen funkciójú enzim, a MASP-3 immunológiai szerepét.
 Az azonosítás folyamán feltárták a vérplazma egyik leghatékonyabb antimikrobiális folyamatának, a komplementrendszer alternatív útjának aktivációs mechanizmusát is. Az eredmények hozzájárulhatnak számos autoimmun kór (egyes vesebetegségek és a vaksághoz vezető időskori makuladegeneráció) terápiájának kifejlesztéséhez.
Az azonosítás folyamán feltárták a vérplazma egyik leghatékonyabb antimikrobiális folyamatának, a komplementrendszer alternatív útjának aktivációs mechanizmusát is. Az eredmények hozzájárulhatnak számos autoimmun kór (egyes vesebetegségek és a vaksághoz vezető időskori makuladegeneráció) terápiájának kifejlesztéséhez.
Veleszületett immunitás, komplementrendszer
A veleszületett immunválasz elemei (molekulák, sejtek) – az ellenanyagokon, B- és T-sejteken alapuló, lassan szerveződő adaptív immunválasszal ellentétben – születésünk pillanatától kezdve folyamatosan készenlétben állnak, hogy veszély esetén akcióba lépjenek, és megvédjék szervezetünk épségét. A komplementrendszer a véralvadási rendszerrel rokonságot mutató fehérjehálózat, amely a veleszületett immunitás központi elemeként haladéktalanul támadást intéz a betolakodó kórokozókkal szemben. Fehérjebontó (proteináz) komponensei inaktív előalak (zimogén) formában termelődnek, és csak veszély esetén aktiválódnak egy másik proteináz molekula általi hasítás révén. Az aktivált proteinázok további zimogéneket hasítanak, ami egy lavinaszerű (kaszkád) folyamatban tömeges proteináz aktiválódáshoz vezet.
Ez az ősi rendszer létfontosságú védvonalat biztosít, amely azonban hibás szabályozása esetén a saját szervezetünket is megtámadhatja. A komplementrendszer három ágon, a klasszikus, a lektin és az alternatív úton aktiválódhat, amelyek közös útvonalban végződnek.
Alternatív út, a D-faktor aktiválódásának rejtélye
A komplementrendszer legpusztítóbb ágának, az alternatív útnak a csúcsán a D-faktor nevű proteináz áll. Ez a kulcsfontosságú enzim kivételes módon nem zimogén, hanem már hasított, aktív állapotban található meg a keringésben. A D-faktor felfedezése óta, azaz mintegy 70 éve rejtély, hogy a vérben mi végzi a zimogén forma hasítását, azaz mi aktiválja ezt az enzimet.
Az enigmatikus MASP-3 proteináz
A komplementrendszer legkésőbb felfedezett proteináza a MASP-3. Az enzimet dán kutatók azonosították 2001-ben, és azonnal éles nemzetközi verseny indult a MASP-3 élettani szerepének kiderítésére. A feladat óriási kihívásnak bizonyult: 15 évnyi, kudarcokkal terhelt kutatás során egyetlen olyan MASP-3 által hasítható fehérjét sem azonosítottak, melynél a hasításnak bizonyíthatóan élettani jelentősége lett volna. A MASP-3 génjének kiütésén alapuló egérkísérletek, illetve örökletesen MASP-3-hiányos emberek vizsgálata ugyan arra utalt, hogy a MASP-3 enzimnek szerepe lehet az alternatív út aktiválásában, de ezek a kutatások komoly ellentmondásokhoz vezettek.
Unikális fejlesztéseinek köszönhetően végül egy hazai kutatógárda oldotta meg mindkét rejtélyt. Az ELTE Természettudományi Kar Biokémiai Tanszék Pál Gábor által alapított Irányított Fehérjeevolúció Kutatócsoportja tíz éve működik sikeresen együtt a Magyar Tudományos Akadémia Természettudományi Kutatóközpont Gál Péter által vezetett Szerkezeti Biofizika Kutatócsoportjával. Utóbbi több évtizede kutatja az immunrendszer – azon belül is a komplementrendszer – működését. A hazai konzorcium négy éve határozta el, hogy megfejti a MASP-3 enzim szerepét.
A felfedezéshez vezető út: génsebészet, irányított evolúció, fluoreszcens nyomkövetés
A Pál Gábor és Gál Péter vezette konzorcium az MASP-3 élettani szerepének tisztázásához három kulcsfontosságú fejlesztést hajtott végre. Laboratóriumi körülmények közt baktériumokban termelve állítottak elő emberi MASP-3 enzimet aktív formában, nagy tisztaságban, génsebészeti módszereket alkalmazva. Mivel a természetben nem ismert MASP-3-gátlószer, a világon elsőként irányított fehérjeevolúcióval kifejlesztettek egy szelektív MASP-3-inhibitort. Emellett kifejlesztettek egy érzékeny mérési módszert, amellyel emberi vérben nyomon tudták követni a zimogén D-faktor aktiválódását. Ehhez a zimogén D-faktort rovarsejtekben termelték, és fluoreszcens festékkel jelölték. A fenti fejlesztéseket elsősorban Szakács Dávid (ELTE Biokémiai Tanszék), valamint Dobó József és Oroszlán Gábor (MTA TTK) végezte.
A rejtélyek megoldása
A kísérletek megdöbbentő eredményre vezettek. Az evolvált szelektív MASP-3-inhibitor tökéletesen meggátolta, hogy az emberi vér eddig azonosítatlan proteináza aktiválja a zimogén D-faktort. A MASP-3 szerepének 15 éves és a D-faktor aktiválásának 70 éves rejtélye egy csapásra megoldódott. Minden kétséget kizáróan bizonyítást nyert, hogy nyugvó vérben (amelyben sem alvadás, sem gyulladás nem zajlik) a MASP-3 a zimogén D-faktor kizárólagos aktivátora. Ez a kettős áttörés és az alternatív út központi szerepe együttesen magyarázza a kutatás tudományos jelentőségét.
Jövőbeni tervek
A MASP-3 enzimmel kapcsolatos hazai kutatások két fő irányban folynak tovább. A tipikus proteináz szabályozást követve a MASP-3 zimogén állapotban kerül ki a termelő sejtekből. Ebben az inaktív állapotában nem képes aktiválni a zimogén D-faktort. Először azt szeretnék tisztázni, hogy nyugvó vérben milyen proteináz aktiválja a zimogén MASP-3 enzimet. Egy másik fontos kérdés, hogy vajon a MASP-3 milyen egyéb fehérjéket képes hasítani. Genetikai vizsgálatok eredményei arra utalnak, hogy egy ritka, súlyos fejlődési rendellenesség, az ún. 3MC szindróma hátterében a MASP-3-gén olyan mutációi állnak, amelyek inaktiválják az enzimet. A betegség kialakulását eszerint az okozhatja, hogy bizonyos, csak vagy elsősorban a MASP-3 által hasított, egyedfejlődést szabályzó fehérjék processzálása elmarad. Az ELTE és az MTA kutatóinak célja ezeknek a fehérjéknek az azonosítása.
Terápiás jelentőség
A komplementrendszer mindhárom útja fontos szerepet tölt be a fertőzések elleni védekezésben. Amikor azonban az egyes utak szabályozása felborul, az a saját sejtek, szövetek pusztításához vezethet. Alzheimer-kórban például igazolt a klasszikus, míg szívinfarktus és szélütés esetében a lektin út kóros szerepe. Az alternatív út bizonyítottan negatív szerepet játszik egyes vesebetegségek és a fejlett, elöregedő ipari társadalmakban leggyakrabban vaksághoz vezető kórkép, az időskori makuladegeneráció kialakulásában. Az alternatív úttal kapcsolatos betegségek kezelésére jelenleg általános (a végső, közös útvonalat blokkoló) komplementrendszer gátlást vagy D-faktoron keresztüli alternatív út gátlást próbálnak bevetni. Az új felfedezés arra hívja fel a figyelmet, hogy az alternatív útra szelektív stratégia esetében a D-faktor mellett a MASP-3 enzim is fontos gyógyszercélpont lehet.
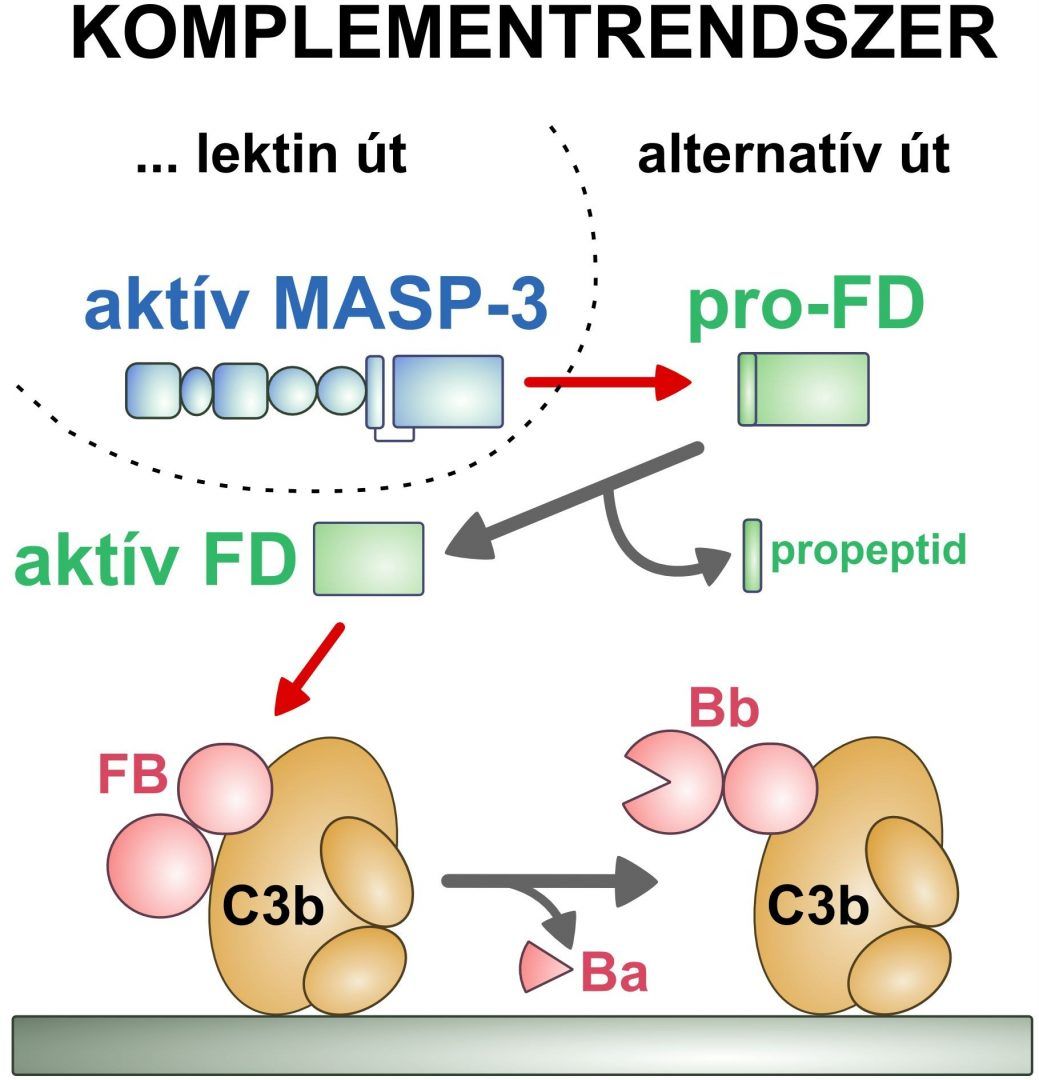
A D-faktor (FD) a komplementrendszer alternatív útvonalának kulcsenzime. Feladata az alternatív út beindítása a C3b-hez kötött B-faktor (FB) aktiválása által. Kódoló génjének szekvenciája alapján a D-faktor egy propeptidet is tartalmazó inaktív zimogén (pro-FD) formában keletkezik. Ezzel szemben a D-faktor szinte kizárólag propeptidet már nem hordozó, aktív formában kering a vérben. Mostanáig nem volt ismert, hogy pontosan mely enzimek hasítják el a vérben keringő D-faktor zimogénjét, és hol zajlik ez az aktiválás. A magyar kutatók bebizonyították, hogy a vérbe jutó D-faktor zimogénjének aktiválását kizárólag a komplementrendszer lektin útjának egyik proteináz komponense, a korábban ismeretlen szerepű MASP-3 végzi. Felfedezésük nyomán nyilvánvalóvá vált, hogy a komplementrendszer e két útvonala között szoros kapcsolat áll fenn. (Az ábrán a piros nyilak proteolitikus hasítást, a szürke nyilak átalakulást jelölnek.)



No Comment