Szerintünk ez az amiloid struktúra nagy dolog, mégis alig beszélünk róla. Pedig felfedezéssel kapcsolatban Perczel András egyetemi tanár,
az MTA-ELTE Fehérjemodellező Kutatócsoport vezetője megérdemel néhány szót. Először is, térszerkezetnek nevezi a szaknyelv a molekulák küllemét és alakját, ami meghatározza a használhatóságot. A molekuláknak és így a fehérjéknek is van szerkezetük, a megjelenésük pedig perdöntő. A molekuláris evolúció 3-4 milliárd éve alatt a fehérjék folyamatosan alakultak és változtak. Viszont mai tudásunk szerint ezalatt az idő alatt a téralkatra nézve csupán csak két sikeres stratégia szerint tették ezt.
Minden fehérje lineáris polimer, amely tartalmaz mind vízkedvelő, mind víztaszító aminosavakat.
Ez utóbbiak értelemszerűen „nehezen férnek meg” a vízzel, amely közeg ad otthont az élő rendszerek legtöbb molekulájának. Az egyik sikerre vezető stratégia az, hogy a fehérjelánc úgy tekeredik fel gyorsan és kompakt módon, hogy a víztaszító aminosavakat a saját belsejébe temeti. A fehérjeevolúció – a rejtegetés kényszere alatt – vizet át nem eresztő, úgynevezett globuláris téralkatok sokaságát eredményezte. A humán genom mintegy húszezer fehérjéjének téralkata 70-85 százalékban globuláris.
A másik stratégia mentén a fehérjeláncban lévő víztaszító, azaz hidrofób aminosavak ismétlődő mutáció során vagy kikoptak, vagy be sem épültek a láncba. A lecsökkent víztaszító aminosavak száma miatt ezeknek a fehérjéknek már nem kell feltekeredniük, nem kell a víz számára átjárhatatlan globuláris téralkatot létrehozniuk. Egyszerűen, mint sikló a vízben, izegve-mozogva töltenek be fontos biológiai funkciókat. A fokozott belső mozgékonyságuk miatt ezeket intrinsically dynamic proteinnek (IDP) nevezik. A minket felépítő nagyjából 37 billió sejt mindegyikében sok-sok ezer fehérje található, melyek csupán kétfélék lehetnek: vagy globuláris fehérjék, vagy IDP-k.
Ma még részben ismeretlen, sejten belüli változásokra visszavezethető okok miatt a szálszerűen kígyózó globuláris fehérjék egy-egy rövidebb szegmense meglazul. Majd ez a részlet másféle vagy önmagához hasonló lánchoz simul, amivel összetapad. Ahogy a folyón úszó farönkök idővel egymás mellé rendeződnek, majd illeszkednek és ezáltal tutajjá kapcsolhatók össze, talán ugyanígy képződik a fehérje harmadik típusú téralkata, az amiloid szabályos nano-struktúrája. Ebben egy képzeletbeli zsaluzás segítségével illeszkednek össze az elemek, és alkotnak megbonthatatlan stabilitású amiloid filamentumot.
Ez a szerkezet az önerősítő önrendeződés során egyre növekvő hosszúságú amiloid szállá áll össze.
Idővel az amiloidok összetorlódnak, és ahogy a jég zajláskor kilép a folyó medréből és torlaszokat épít, úgy nőnek és terjeszkednek az amiloid struktúrák egyre nagyobbra. Majd aztán szétfeszítik sejtes környezetüket. A normál sejtekben a fehérjesűrűség nagy, ezért tudnak gyorsan növekedni, egymáshoz tapadni az amiloidok. Idővel a normál celluláris működés megbomlik, a sejtes struktúra szétesik, a szövet, a szerv pusztulásnak indul. Ilyen módon veszti el az alzheimeres beteg folyamatosan és visszavonhatatlanul egyre több idegsejtjét. Emiatt a személy kognitív és vegetatív képességei drámai romlásnak indulnak. A mentális leépülés hátterében az amiloid plakkok számának növekedése és a neuronok felgyorsult pusztulása áll. Noha jelenleg még nem bizonyított, hogy ebben a láncolatban mi az ok és az okozat.
30-50 évvel ezelőtt azt hittük, hogy csak néhány fehérje van, amelyik hibásan hasad vagy természetes lebomlása közben egy-egy átmeneti terméke felgyülemlik, és ez okozza a bajt, az amiloidok megjelenését. Például az Amiloid Precursor Protein, röviden APP hasadása során keletkezik az emberben az Aβ1-42 szálszerűen kígyózó rövidebb fehérjedarab, amelynek a neuronokban megnövekedett koncentrációja amiloidot képezhet és Alzheimer-kórt eredményezhet, amely a demenciák csaknem 60 százalékért felelős, és amelyre jelenleg sajnos még semmilyen gyógymód sincs. Ma azt gondoljuk, hogy a genom lényegében bármely fehérjéje képezhet akár végzetes amiloidot. Bizonyos körülmények között feltekeredhet ebbe a 3. típusú fehérjetérszerkezetbe.
A helyzet nem örömteli. Úgy tíz éve, elméleti megfontolások és alkalmazott kvantumkémia számításokkal bizonyítottuk azt a termodinamikai hipotézist, hogy bármely fehérje számára felvehető az amiloid térszerkezetet.
Az amiloid igazi fehérjetemető, a fehérjeképződés zsákutcája ez. Az amiloid képződés során lényegében béta-redőzött rétegek téralkatok kapcsolódónak rendezett módon egymás mellé. Az egyre növekvő méretű amiloid nanostruktúrák egyre megbonthatatlanabbak, egyre erősebben tapadnak egymáshoz.
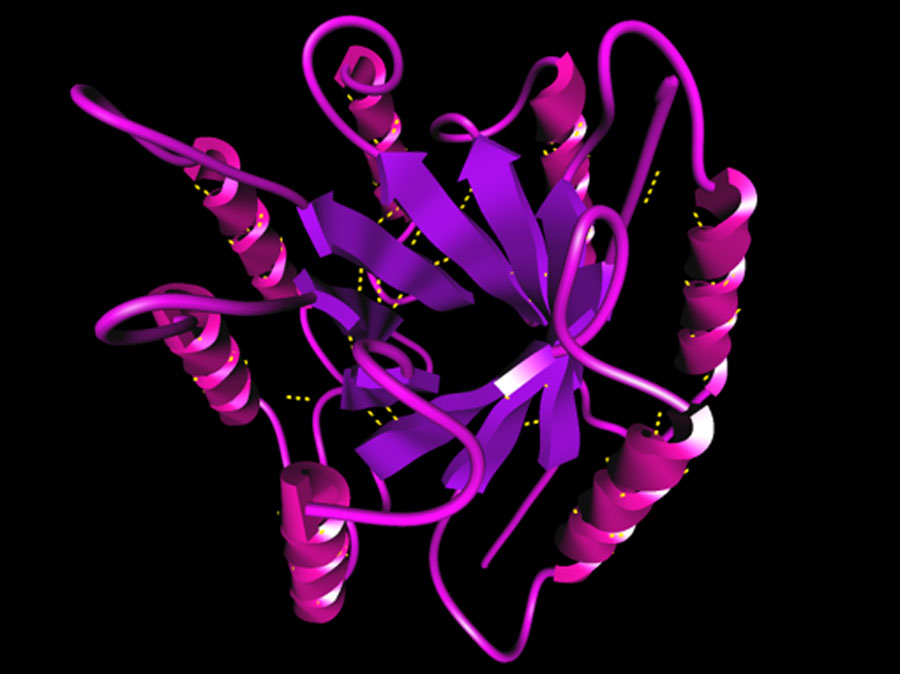
De β-redőzött téralkattal tele vannak az egészségesen működő globuláris fehérjék. A fehérjék spirálszerű, alfa-hélixnek nevezett térbeli alakzata mellett, a nyújtott alakzatú béta-redő a második legelterjedtebb és jól felismerhető forma a fehérjékben (lásd a képen lila spirálok és magenta nyilak). Ám ideális fiziológiás körülmények közepette ez a nyújtott téralkat szigorú „kontroll alatt van”, soha sincs „egyedül hagyva” éppen azért, hogy nehogy amiloid képződést kezdeményezzen.
Az elmúlt évtizedben százával jelentek meg olyan cikkek, amelyek egy-egy fehérje esetében amiloidképződésről számoltak be.
Ám olyan munka, amelyik a sejtes körülmények szisztematikus feltérképezésének, a pH, a hőmérséklet, a fehérjekoncentráció függvényében vizsgálja az amiloidképződés lehetőségét és tényét, vagy annak molekuláris mechanizmusát ma is ritka. Mert nehéz. Perczel és kollégái a II-es típusú cukorbetegség gyógyítása során használt fehérjegyógyszer, az Exenatid általuk fejlesztett variánsainak amiloidképződését térképezték fel. Majd leírták a munka általánosítható tapasztalatait. Ráadásul egy spektroszkópiai módszert is kifejlesztettek a folyamat lépésenkénti monitorozása érdekében. Olyat, amely teljesen általános és bármely fehérje amiloidózisa során alkalmazható. Kiroptikai módszerük széles körben használható, és betekintést enged az amiloid téralkat kialakulásának részleteibe is.





No Comment