Az ELTE kutatói egyedülálló, kutatásokat forradalmasító módszert dolgoztak ki a nehezen kristályosodó fehérjék atomi szintű szerkezetvizsgálatában.
Nyitray László professzor, a Biokémiai Tanszék vezetőjének kutatócsoportja új felfedezésről számolt be, amely a fehérjék atomjainak minél hatékonyabb meghatározását tűzte ki célul. A fehérjék szerkezetkutatása új módszerével hosszabb távon olyan terápiás gyógyszerhatóanyagok is készülhetnek, amelyek csökkenthetik bizonyos tumorok áttétének kialakulását.
A fehérjék szerkezetkutatása, molekuláris szintű működésének feltárása bonyolult folyamat, ebben is a legösszetettebb a fehérjék atomi szintű szerkezetének meghatározása. A kutatók számára azonban elengedhetetlen, hogy az atomszerkezetről grafikai képet kapjanak, hiszen ez megkönnyíti az adott fehérje működésének megértését. Ilyen molekuláris ábrák segítségével sikerült nemrég érthetőbbé tenni a koronavírus szerkezetét és annak a gazdasejtekhez való kötődését is.
Jelenleg a fehérjeszerkezet-kutatóknak három módszer áll a rendelkezésére, amellyel megismerhetik egy-egy fehérje alakját: a röntgenkrisztallográfia, az NMR spektroszkópia és a néhány éve Nobel-díjakat eredményező krio-elektronmikroszkópia (krio-EM).
Bár a krio-EM felfedezése szinte forradalmasította a fehérjék szerkezetkutatását, hátránya, hogy csak bizonyos méret feletti fehérjék vizsgálhatók vele. Ezért a kutatóknak gyakran nem marad más választása, mint a legrégebb óta alkalmazott röntgenkrisztallográfiához fordulni. Ennél a módszernél azonban kristályosítani kell a fehérjéket. Ebben segíthet a most közölt módszertani újítás.
A krisztallográfusoknak nagyon nehéz megtalálni azt a pontot, amelyben a fehérjék kristályrácsba rendeződnek. Ilyenkor bevonnak egy segédfehérjét, amelyet a célfehérjéhez kapcsolnak. Eddig egyedül az úgynevezett maltóz-kötő fehérjét (MBP) használták széles körben erre a célra, de nagy szükség van több, hasonlóan jó vagy még jobb tulajdonságokkal bíró segédfehérjére.
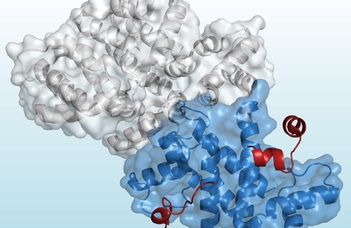
A Biokémiai Tanszék kutatói felfedezték, hogy az annexin-A2 (ANXA2) nevű membránkötő-fehérje alkalmas erre a célra. Sőt, az ELTE kutatói által azonosított fehérje az MBP-nél jobb kristályosodási képességgel rendelkezik és felhasználható a folyamat végén, a fehérjék tisztítása során is.
„Az ANXA2 használatával, a p53 tumorszupresszor-fehérje és a metasztázisok kialakulásával összefüggésbe hozható S100A4 fehérje komplexének atomi felbontású szerkezetét is sikerült meghatározni” – mondta Ecsédi Péter posztdoktor.
A fehérjék szerkezetkutatása új módszere közelebb viheti a kutatókat olyan terápiás célú gátlómolekulák tervezéséhez, amelyek egyes tumoros áttétek kialakulását csökkenthetik.



No Comment