A magyar kutatók által most feltérképezett RNS-módosító mechanizmus az RNS terápiás célú szerkesztésére is lehetőséget nyújt.
A nukleinsavak különböző módosulásai jelentős szerepet játszanak a genetikai információ dekódolásában. A DNS epigenetikai, vagyis a genetikai szekvenciát nem érintő módosulásainak szerepe évtizedek óta széleskörűen tanulmányozott területnek számít. Ugyanakkor az elmúlt évek rávilágítottak arra, hogy az RNS-nek is számos hasonló, úgynevezett epitranszkriptomikus módosulása szintén fontos biológiai szerepet tölt be. Az epitranszkriptomikus módosulás minden funkcionálisan lényeges RNS módosulás, amely nem változtatja meg a szekvenciát (ribonuleotid sorrendet)). Analóg fogalom a DNS epigenetikus módosulásaival. Az ELKH Természettudományi Kutatóközpont (TTK), az Eötvös Loránd Tudományegyetem (ELTE), a Budapesti Műszaki és Gazdaságtudományi Egyetem (BME) és a Semmelweis Egyetem (SE) kutatói a közelmúltban publikált tanulmányukban egy ilyen RNS-módosító mechanizmus részleteit ismertették. A kutatók rámutattak, hogy bár a mechanizmus sérülése genetikai betegségekhez vezethet, pontosabb megértése terápiás lehetőséget is rejt.
Az uridin pszeudouridinné való átalakulása az RNS leggyakoribb módosulása a DNS-ről való átíródás után. A reakciót egy nagy méretű fehérje-RNS komplex, a box H/ACA pszeudouridin szintáz katalizálja. A komplex fehérjealkotóinak mutációja daganatos betegségek, csontvelőhiány és nefrotikus szindróma kialakulását okozhatja.
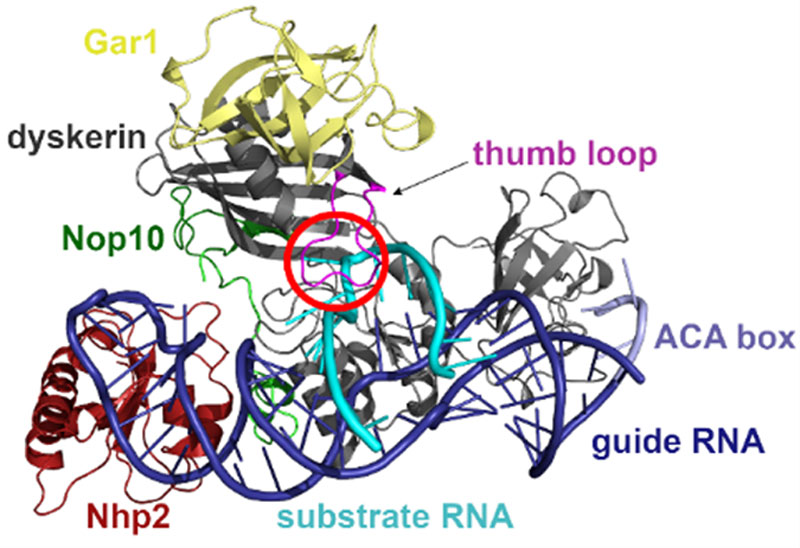
A kutatók felépítették a pszeudouridin szintáz komplex modelljét.
Nagy számítógép-teljesítményt igénylő szimulációk segítségével azonosították az atomok helyzetének és kölcsönhatásainak változását. Emellett a kémiai kötések átalakulásának mechanizmusát is feltárták az uridin pszeudouridinné való transzformációja során. Azt találták, hogy az átalakítandó RNS olyan torzult formában kötődik a box H/ACA pszeudouridin szintázhoz, amely megkönnyíti a kötődést követő uridin-pszeudouridin átalakítást. Azt is megmutatták, hogy az enzim mutáns variánsai nem torzítják a megkötött RNS uracilját, ami összhangban van ezen mutánsok kísérletileg észlelt inaktivitásával.
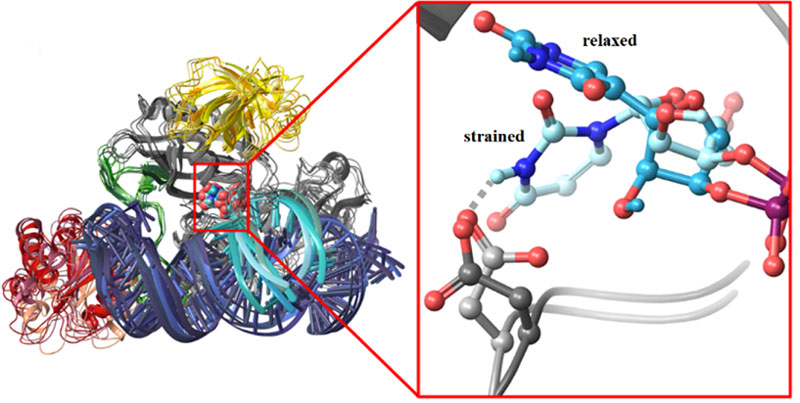
A kutatók rámutattak, hogy az azonosított mechanizmus lehetővé teszi az uracil átalakítását bármely olyan tetszőleges RNS-ben, amely képes megfelelően kötődni a box H/ACA pszeudouridin szintáz vezérlő RNS-éhez. Továbbá hogy a vezérlő RNS szerkezete nagymértékben változtatható. Ilyen módon a box H/ACA pszeudouridin szintázhoz kötött, alkalmasan tervezett vezérlő RNS szinte bármely tetszőleges RNS szubsztrát uraciljának átalakítását képes elvégezni a szervezeten belül. Ez a szakemberek számára lehetőséget teremt az RNS szerkesztésére és génhibákhoz kötődő betegségek gyógyítására.
Az RNS három altípusú: mRNS, tRNS és rRNS.
Így az emberek óhatatlanul a COVID-vakcinákhoz is kapcsolják őket. De ebben a viszonylatban az RNS terápiás célú szerkesztése programozott uridine-pszeudouridin átalakítást jelent. Ferenczy György kandidátus (ELTE TTK) segített tisztázni nekünk a lényeget, ami a következő. A kutatók által vizsgált mechanizmus azt mutatja, hogy alkalmasan választott célzó funkciójú snoRNS (small nucleolar RNS) szervezetbe juttatásával a sejtekben jelen levő diszkerin segítségével olyan fehérje-RNS komplex képződik, amely szinte tetszőleges RNS-en képes uridine-pszeudouridin transzformációt végrehajtani.
Az így módosított RNS egyrészt egyszerű pszeudouridint tartalmaz, amely eltér a ma alkalmazott COVID-vakcinák metilezett pszeudouridinjétől. Másrészt szemben az utóbbiakkal, nem korlátozódik mRNS-re. A terápiás célú kezelés a felfedezés kontextusában arra vonatkozik, hogy célzott pszeudouridilációval meg lehet növelni egyes mRNS-ek stabilitását, transzlációjuk hatékonyságát, vagy különleges esetekben a róluk leolvasott aminosav-szekvencia összetételét is. Ez főleg olyan betegségek esetében lehet potenciálisan fontos és képezheti további vizsgálatok tárgyát, ahol a betegséget kiváltó mutáció vagy egy adott fehérje mennyiségét érinti. Vagy annak az aminosav-összetételét, vagy – és talán ez a leggyakoribb – egy mutáció miatt nem a teljes fehérje készül el.







No Comment